- Биологическая и физиологическая роль
- Молекула OF2 полярна или неполярна?
- 1) Электроотрицательность:
- 2) Геометрическая/молекулярная форма:
- 3) Дипольный момент:
- История
- Происхождение названия
- Получение
- Лабораторный метод
- Промышленный метод
- Тест ЕГЭ по химии. А3.Химическая связь.
- Физические свойства
- Электронное строение
- Строение молекулы
- Кристаллы
- Изотопный состав
- Ядерные свойства изотопов фтора
- Магнитные свойства ядер
- Как нарисовать структуру Льюиса для OF2?
- Шаг 1: Подсчитайте общее количество валентных электронов, присутствующих в молекуле OF2.
- Шаг 2: Найдите наименее электроотрицательный элемент в OF2 молекула
- Шаг 6: Проверьте формальную стоимость оплаты
- Химические свойства
- Ковалентная связь
- Энергия и длина ковалентной связи
- Как найти молекулярную форму и электронную геометрию молекулы OF2?
- 1) Найдите количество неподеленных пар, присутствующих на центральном атоме в структуре Льюиса молекулы OF2.
- Количество неподеленных пар также можно найти по формуле
- 2) Найдите число гибридизации молекулы OF2
- 3) Используйте теорию VSEPR для определения молекулярной/электронной геометрии OF2.
- Молекула — фтор
Биологическая и физиологическая роль
Фтор является жизненно необходимым для организма элементом. В организме человека фтор в основном содержится в эмали зубов в составе фторапатита — Ca5F(PO4)3 — и в костях. Общее содержание составляет 2,6 г, в том числе в костях 2,5 г. Нормальное суточное поступление фтора в организм человека равно 2,5—3,5 мг. При недостаточном (менее 0,5 мг/литр питьевой воды) или избыточном (более 1 мг/литр) потреблении фтора организмом могут развиваться заболевания зубов: кариес и флюороз (крапчатость эмали) и остеосаркома, соответственно.
Малое содержание фтора разрушает эмаль за счёт вымывания фтора из фторапатита с образованием гидроксоапатита, и наоборот.
Для профилактики кариеса рекомендуется использовать зубные пасты с добавками фторидов (натрия и/или олова) или употреблять фторированную воду (до концентрации 1 мг/л), или применять местные аппликации 1—2 % раствором фторида натрия или фторида олова. Такие действия могут сократить вероятность появления кариеса на 30—50 %.
Предельно допустимая концентрация связанного фтора (в виде фторидов и фторорганических соединений) в воздухе промышленных помещений равна 0,0005 мг/литр воздуха.
Молекула OF2 полярна или неполярна?
OF2 является полярной молекулой, что подтверждается тремя факторами
1) Электроотрицательность:
Фтор (электроотрицательность 4) более электроотрицательный, чем кислород (электроотрицательность 3.5). Будучи более электроотрицательным, чем кислород, фтор сильнее притягивает к себе электроны.
Молекула называется полярной, если разность электроотрицательностей атомов в молекуле больше 0.4.
Разница между электроотрицательностями кислорода и фтора составляет 0.5.
2) Геометрическая/молекулярная форма:
Форма молекулы OF2 изогнута.
Два диполя – отрицательный заряд на атоме фтора и положительный заряд на атоме кислорода – не могут быть отменены из-за изогнутой молекулярной формы OF2.
3) Дипольный момент:
Дипольный момент существует в молекуле OF2 из-за полярности связи OF. Этот дипольный момент будет направлен к более электроотрицательному атому фтора, поскольку атом фтора пытается притянуть к себе электрон.
Изогнутая форма молекулы OF2 обусловлена наличием 2 неподеленных пар электронов на центральном атоме кислорода. Из-за изогнутой формы оба этих дипольных момента не компенсируются, а суммируются, делая OF2 полярной молекулой.
Все эти факторы показывают, что OF2 является полярной молекулой.
Атом кислорода центрального атома делит два электрона с обоими атомами фтора. Следовательно, в Структура Льюиса наличие двух связывающих пар электронов на атоме кислорода и двух несвязывающих пар, т.е. двух неподеленных пар на атоме кислорода в Структура Льюиса молекулы OF2
История
Первое соединение фтора — флюорит (плавиковый шпат) CaF2 — описано в конце XV века под названием «флюор». В 1771 году Карл Шееле получил плавиковую кислоту. При обработке минерала флюорита CaF2 серной кислотой он выделил HF в виде водного раствора. Это событие рассматривается в истории химии как открытие фтора. Аналогию с хлором предложил в 1810 г. Андре Ампер, его поддержал Гемфри Дэви. Дэви изучил растворения стекла в плавиковой кислоте.
Как химический элемент, входящий в состав плавиковой кислоты, фтор был предсказан в 1810 году, а выделен в свободном виде лишь 76 лет спустя Анри Муассаном в 1886 году электролизом жидкого безводного фтористого водорода, содержащего примесь кислого фторида калия KHF2.
Происхождение названия
Название «фтор» (от др.-греч. φθόρος — «разрушение, порча, вред»), предложенное Андре Ампером в 1810 году, употребляется в русском и некоторых других языках; во многих странах приняты названия, производные от лат. fluorum (от fluere — «течь», — по способности некоторых соединений фтора, например флюорита (CaF2), понижать температуру плавления металлургического шлака, образующегося при восстановлении металлов из руд, и увеличивать его текучесть.
Получение
Лабораторный метод получения фтора
Промышленный способ получения фтора включает добычу и обогащение флюоритовых руд, сернокислотное разложение их концентрата с образованием безводного HF и его электролитическое разложение.
Для лабораторного получения фтора используют разложение некоторых соединений, но все они не встречаются в природе в достаточном количестве, и их получают с помощью свободного фтора.
Лабораторный метод
- В лабораторных условиях фтор можно получать с помощью показанной установки. В медный сосуд 1, заполненный расплавом KF·3HF, помещают медный сосуд 2, имеющий отверстия в дне. В сосуд 2 помещают толстый никелевый анод. Катод помещается в сосуд 1. Таким образом, в процессе электролиза газообразный фтор выделяется из трубки 3, а водород — из трубки 4. Важным требованием является обеспечение герметичности системы, для этого используют пробки из фторида кальция со смазкой из оксида свинца(II) и глицерина.
- В 1986 году, во время подготовки к конференции по поводу празднования 100-летия открытия фтора, Карл Кристе открыл способ чисто химического получения фтора с использованием реакции во фтороводородном растворе K2MnF6 и SbF5 при 150 °C:
-
- 2K2MnF6 + 4SbF5 → 4KSbF6 + 2MnF3 + F2↑
Хотя этот метод не имеет практического применения, он демонстрирует, что электролиз необязателен; кроме того, все компоненты для данных реакций могут быть получены без использования газообразного фтора.
Также для лабораторного получения фтора можно использовать нагрев фторида кобальта(III) до 300 °C, разложение фторидов серебра и некоторые другие способы.
Промышленный метод
Промышленное производство фтора осуществляется электролизом расплава кислого фторида калия KF·2HF (часто с добавлениями фторида лития), который образуется при насыщении расплава KF фтористым водородом до содержания 40—41 % HF. Процесс электролиза проводят при температурах около 100 °C в стальных электролизёрах со стальным катодом и угольным анодом.
Тест ЕГЭ по химии. А3.Химическая связь.
Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая, водородная. Способы образования ковалентной связи. Характеристики ковалентной связи: длина и энергия связи. Образование ионной связи.
1. В аммиаке и хлориде бария химическая связь соответственно
1) ионная и ковалентная полярная
2) ковалентная полярная и ионная
3) ковалентная неполярная и металлическая
4) ковалентная неполярная и ионная
2. Вещества только с ионной связью приведены в ряду:
1) F2, ССl4, КС1
2) NaBr,Na2O,KI
3) SO2.P4.CaF2
4) H2S,Br2,K2S
3. Соединение с ионной связью образуется при взаимодействии
1) СН4 и О2
2) SO3 и Н2О
3) С2Н6 и HNO3
4) NH3 и HCI
4. В каком ряду все вещества имеют ковалентную полярную связь?
1) HCl,NaCl.Cl2
2) O2.H2O.CO2
3) H2O.NH3.CH4
4) NaBr.HBr.CO
5. В каком ряду записаны формулы веществ только с ковалентной полярной связью?
1) С12, NO2, НС1
2) HBr,NO,Br2
3) H2S.H2O.Se
4) HI,H2O,PH3
6. Ковалентная неполярная связь характерна для
1) С12 2) SO3 3) СО 4) SiO2
7. Веществом с ковалентной полярной связью является
1) С12 2) NaBr 3) H2S 4) MgCl2
8. Веществом с ковалентной связью является
1) СаС122) MgS 3) H2S 4) NaBr
9. Вещество с ковалентной неполярной связью имеет формулу
1) NH32) Сu 3) H2S 4) I2
10. Веществами с неполярной ковалентной связью являются
1) вода и алмаз
2) водород и хлор
3) медь и азот
4) бром и метан
11. Между атомами с одинаковой относительной электроотрицательностью образуется химическая связь
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) водородная
12. Ковалентная полярная связь характерна для
1) KC1 2) НВг 3) Р4 4) СаСl2
13. Химический элемент, в атоме которого электроны по слоям распределены так: 2, 8, 8, 2 образует с водородом химическую связь
1)ковалентную полярную
2) ковалентную неполярную
3) ионную
4) металлическую
14. В молекуле какого вещества длина связи между атомами углерода наибольшая?
1} ацетилена 2) этана 3) этена 4) бензола
15. Тремя общими электронными парами образована ковалентная связь в молекуле
1) азота
2) сероводорода
3) метана
4) хлора
16. Водородные связи образуются между молекулами
1) диметилового эфира
2) метанола
3) этилена
4) этилацетата
17. Полярность связи наиболее выражена в молекуле
1) HI 2) НС1 3) HF 4) НВг
18. Веществами с неполярной ковалентной связью являются
1) вода и алмаз
2) водород и хлор
3) медь и азот
4) бром и метан
19. Водородная связь не характерна для вещества
1) Н2О 2) СН4 3) NH3 4) СНзОН
20. Ковалентная полярная связь характерна для каждого из двух веществ, формулы которых
1) KI и Н2О
2) СО2 и К2О
3) H2S и Na2S
4) CS2 и РС15
21. Наименее прочная химическая связь в молекуле
1) фтора 2) хлора 3} брома 4} иода
22. В молекуле какого вещества длина химической связи наибольшая?
1) фтора 2) хлора 3) брома 4) иода
23. Ковалентные связи имеет каждое из веществ, указанных в ряду:
1) C4H10, NO2, NaCl
2} СО, CuO, CH3Cl
3} BaS,C6H6,H2
4} C6H5NO2, F2, CC14
24. Ковалентную связь имеет каждое из веществ, указанных в ряду:
1) СаО,С3Н6, S8
2) Fe.NaNO3, CO
3) N2, CuCO3, K2S
4) C6H5N02, SО2, CHC13
25. Ковалентную связь имеет каждое из веществ, указанных в ряду:
1} С3Н4, NO, Na2O
2) СО, СН3С1, PBr3
3) Р2Оз, NaHSO4, Сu
4) C6H5NO2, NaF, СС14
26. Ковалентные связи имеет каждое из веществ, указанных в ряду:
1) C3Ha,NO2, NaF
2) КС1, CH3Cl, C6H1206
3) P2O5, NaHSO4, Ba
4) C2H5NH2, P4, CH3OH
27. Полярность связи наиболее выражена в молекулах
1) сероводорода
2) хлора
3) фосфина
4) хлороводорода
28. В молекуле какого вещества химические связи наиболее прочные?
1)СF4
2)CCl4
3)CBr4
4)CI4
29. Среди веществ NH4Cl, CsCl, NaNO3, PH3, HNO3 — число соединений с ионной связью равно
|
1) |
1 |
|
2) |
2 |
|
3) |
3 |
|
4) |
4 |
30. Среди веществ (NH4)2SO4, Na2SO4, CaI2, I2, CO2 — число соединений с ковалентной связью равно
|
1) |
1 |
|
2) |
2 |
|
3) |
3 |
|
4) |
4 |
Ответы: 1-2, 2-2, 3-4, 4-3, 5-4, 6-1, 7-3, 8-3, 9-4, 10-2, 11-3, 12-2, 13-3, 14-2, 15-1, 16-2, 17-3, 18-2, 19-2, 20-4, 21-4, 22-4, 23-4, 24-4, 25-2, 26-4, 27-4, 28-1, 29-3, 30-4
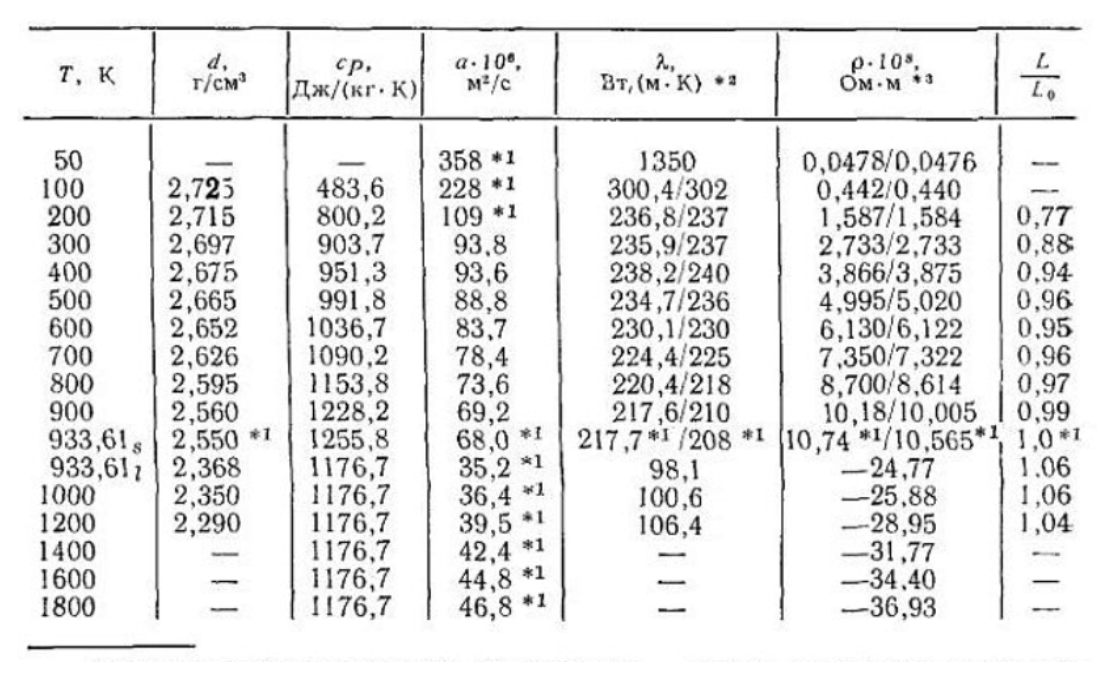
Физические свойства
При нормальных условиях представляет собой бледно-жёлтый газ. В малых концентрациях в воздухе его запах напоминает одновременно озон и хлор. Очень агрессивен и ядовит.
Фтор имеет аномально низкую температуру кипения (85,03 К, −188,12 °C) и плавления (53,53 К, −219,70 °C). Это связано с тем, что фтор не имеет d-подуровня и не способен образовывать полуторные связи, в отличие от остальных галогенов (кратность связи в остальных галогенах примерно 1,1).
Ниже температуры плавления образует кристаллы бледно-жёлтого цвета.
Электронное строение
Электронная конфигурация атома фтора: 1s22s22p5.
Атомы фтора в соединениях могут проявлять степень окисления, равную −1. Положительные степени окисления в соединениях неизвестны, так как фтор является самым электроотрицательным элементом.
Квантовохимический терм атома фтора — 2P3/2.
Строение молекулы
Применение метода МО для молекулы F2
С точки зрения теории молекулярных орбиталей, строение двухатомной молекулы фтора можно охарактеризовать следующей диаграммой. В молекуле присутствует 4 связывающих орбитали и 3 разрыхляющих. Порядок связи в молекуле равен 1.
Кристаллы
Кристаллическая структура α-фтора (стабильная при атмосферном давлении)
Фтор образует молекулярные кристаллы с двумя кристаллическими модификациями, стабильными при атмосферном давлении:
- α-фтор, непрозрачный, твёрдый и хрупкий, существует при температуре ниже 45,6 K, кристаллическая решётка моноклинной сингонии, пространственная группа C 2/c, параметры ячейки a = 0,54780(12) нм, b = 0,32701(7) нм, c = 0,72651(17) нм, β = 102,088(18)°, Z = 4, d = 1,98 г/см3 с объёмом элементарной ячейки 0,12726(5) нм3 (при 10 К);
- β-фтор, прозрачный и менее плотный и твёрдый, существует в интервале температур от 45,6 К до точки плавления 53,53 K, кристаллическая решётка кубической сингонии (примитивная решётка), пространственная группа Pm3n, параметры ячейки a = 0,65314(15) нм, Z = 8, d = 1,81 г/см3 с объёмом элементарной ячейки 0,27862(11) нм3 (при 48 К), решётка изотипична γ-фазе O2 и δ-фазе N2. Следует отметить, что в раннем (но единственном проведённом до 2019 года) эксперименте по изучению структуры β-фтора рентгенографическая плотность кристалла была оценена как 1,70(5) г/см3, и эта плотность твёрдого фтора цитируется в большинстве справочников. Более точное современное измерение даёт 1,8104(12) г/см3.
Фазовый переход между этими кристаллическими фазами фтора более экзотермичен, чем затвердевание жидкого фтора. Фаза ромбической сингонии у твёрдого фтора не обнаружена, в отличие от всех прочих галогенов. Молекулы α-фтора разупорядочены по направлению. Длина связи F—F в молекулах составляет 0,1404(12) нм.
Даже при столь низких температурах взаимодействие кристаллов фтора со многими веществами приводит к взрыву.
Изотопный состав
Основная статья: Изотопы фтора
Фтор является моноизотопным элементом: в природе существует только один стабильный изотоп фтора 19F. Известны ещё 17 радиоактивных изотопов фтора с массовым числом от 14 до 31, и один ядерный изомер — 18mF. Самым долгоживущим из радиоактивных изотопов фтора является 18F с периодом полураспада 109,771 минуты, важный источник позитронов, использующийся в позитрон-эмиссионной томографии.
Ядерные свойства изотопов фтора
| Изотоп | Относительная масса, а. е. м. | Период полураспада | Тип распада | Ядерный спин | Ядерный магнитный момент |
|---|---|---|---|---|---|
| 17F | 17,0020952 | 64,5 c | β+-распад в 17O | 5/2 | 4,722 |
| 18F | 18,000938 | 1,83 часа | β+-распад в 18O | 1 | |
| 19F | 18,99840322 | Стабилен | — | 1/2 | 2,629 |
| 20F | 19,9999813 | 11 c | β−-распад в 20Ne | 2 | 2,094 |
| 21F | 20,999949 | 4,2 c | β−-распад в 21Ne | 5/2 | |
| 22F | 22,00300 | 4,23 c | β−-распад в 22Ne | 4 | |
| 23F | 23,00357 | 2,2 c | β−-распад в 23Ne | 5/2 |
Магнитные свойства ядер
Ядра изотопа 19F имеют полуцелый спин, поэтому возможно применение этих ядер для ЯМР-исследований молекул. Спектры ЯМР-19F являются достаточно характеристичными для фторорганических соединений.
Как нарисовать структуру Льюиса для OF2?
Ниже приведены шаги, которые необходимо выполнить, чтобы нарисовать структуру Льюиса. молекула OF2
Шаг 1: Подсчитайте общее количество валентных электронов, присутствующих в молекуле OF2.
Первый шаг — найти нет. валентных электронов, присутствующих в молекуле OF2.
Кислород принадлежит к 16-й группе, а фтор — к 17-й группе периодической таблицы.
Валентный электрон кислорода = 6
Валентный электрон фтора = 7
| Валентные Электроны | Атом в OF2 | Всего электронов | |
| O | 6 | 1 | 1 * 6 = 6 |
| F | 7 | 2 | 7 * 2 = 14 |
| 20 |
Настольные: Всего валентных электронов OF2 молекула
Шаг 2: Найдите наименее электроотрицательный элемент в OF2 молекула
Электроотрицательность в периоде увеличивается слева направо, поэтому кислород менее электроотрицателен, чем фтор. Держите наименее электроотрицательный атом в центре.
Теперь нарисовать скелетную структуру молекулы OF2
Ф О Ф
Шаг 2: Как рисовать Структура точек Льюиса
Ф : О : Ф
or
Ф – О – Ф
Шаг 3: Как нарисовать структуру Льюиса
Шаг 6: Проверьте формальную стоимость оплаты
Прежде чем мы подтвердим, что это идеальный Структура Льюиса, нам нужно проверить формальные значения заряда
Формальный заряд = валентные электроны – (1/2) * связывающие электроны – несвязывающие электроны
Валентные электроны кислорода = 6
Несвязывающие электроны кислорода = 4 (2 неподеленные пары)
Связывающие электроны кислорода = 4 (2 пары)
Формальный заряд атома кислорода = 6 – 1/2*4 – 4 = 0
Валентные электроны фтора = 7
Несвязывающие электроны фтора = 6 (3 неподеленные пары)
Связывающие электроны фтора = 2
Формальный заряд атома фтора =7 – 1/2*2 – 6 = 0
Поскольку элементы F и O имеют наименьшие возможные формальные заряды, мы получили подходящие Структура Льюиса
Химические свойства
Самый активный неметалл, бурно взаимодействует почти со всеми веществами (кроме фторидов в высших степенях окисления и редких исключений — фторопластов) и с большинством из них — с горением и взрывом. Образует соединения со всеми химическими элементами, кроме гелия, неона, аргона.
К воздействию фтора при комнатной температуре устойчивы некоторые металлы за счёт образования на их поверхности плотной плёнки фторида, тормозящей реакцию со фтором, например, Al, Mg, Cu, Ni. Контакт фтора с водородом приводит к воспламенению и взрыву в кварцевых сосудах даже при очень низких температурах (до −252 °C), в магниевых сосудах для начала реакции нужен небольшой нагрев.
В атмосфере фтора горят даже вода и платина.
Продукты реакции фтора с водой, в зависимости от условий её протекания, могут различаться:
-
- 2F2 + 2H2O → 4HF↑ + O2↑
- 12F2 + 11H2O → 19HF↑ + H2O2 + HOF ↑ + O2↑ + O3↑ + OF2 ↑ + O2F2↑
-
- Pt + 2F2 →350−400oC PtF4
К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например:
-
- 2CoF3 → 2CoF2 + F2↑
-
- 2MnF4 → 2MnF3 + F2↑
Фтор также способен окислять в электрическом разряде кислород, образуя дифторид кислорода OF2 и диоксидифторид O2F2. Под давлением или при облучении ультрафиолетом реагирует с криптоном и ксеноном с образованием фторидов благородных газов.
Во всех соединениях фтор проявляет степень окисления −1. Чтобы фтор проявлял положительную степень окисления, требуется создание эксимерных молекул или иные экстремальные условия. Это требует искусственной ионизации атомов фтора.
Не реагирует с гелием, неоном, аргоном, азотом, кислородом, тетрафторметаном. При комнатной температуре не реагирует с сухим сульфатом калия, углекислым газом и закисью азота. Без примеси фтороводорода при комнатной температуре не действует на стекло.
Ковалентная связь
Основным типом химических связей в органических соединениях является ковалентная связь. Рассмотрим механизм её образования и основные характеристики.
Простейший пример соединения с ковалентной связью — молекула водорода Н2. Атом водорода состоит из положительно заряженного ядра и одного неспаренного электрона, занимающего 1s-орбиталь. При сближении двух атомов водорода происходит перекрывание их электронных облаков:
![]()
В результате в пространстве между ядрами происходит увеличение электронной плотности, то есть в этой области концентрируется отрицательный заряд. Этот отрицательный заряд притягивает положительно заряженные ядра, и между атомами формируется химическая связь. Образуется молекула водорода , или Н2. Такая связь называется ковалентной. Чем больше перекрываются электронные облака атомов, тем прочнее будет ковалентная связь.
Схему образования ковалентной связи между атомами водорода можно представить следующим образом:
![]()
или:
![]()
Из представленной схемы видно, что ковалентная связь осуществляется посредством общей электронной пары. В электронных формулах электронную пару обычно обозначают двумя точками, расположенными между атомами. Если вокруг таких атомов описать окружности, видно, что каждый атом водорода в молекуле имеет завершённую электронную оболочку, как у атома гелия:
В структурных формулах ковалентная связь обозначается чёрточкой:
Используя понятие общей электронной пары, можно дать краткое определение ковалентной связи.
| Ковалентная связь — химическая связь, образованная посредством общих электронных пар. |
В молекуле водорода общая электронная пара формируется за счёт неспаренных электронов двух атомов водорода. Следовательно, можно заключить, что число ковалентных связей, которое может образовать элемент, равно числу неспаренных электронов в его атоме.
Например, в атоме водорода один неспаренный электрон, поэтому водород может образовать только одну ковалентную связь. Число ковалентных связей, которое образует данный атом в химическом соединении, называется его валентностью. Например, поскольку валентность водорода равна единице, то в структурных формулах от символа H следует рисовать одну чёрточку:
Энергия и длина ковалентной связи
Важнейшими характеристиками ковалентной связи являются её энергия и длина.
Энергия, которую необходимо затратить для разрыва химической связи, называется энергией связи. Энергия связи измеряется в кДж/моль. Чем прочнее связь, тем больше энергии необходимо затратить на её разрыв, следовательно, тем больше энергия связи.
Энергия кратных связей больше, чем одинарных (табл. 4.1). Это вполне понятно, так как для разрушения двух или трёх связей требуется затратить больше энергии, чем для разрыва одной связи.
Атомы, соединённые химической связью, находятся на определённом расстоянии друг от друга. Расстояние между ядрами атомов, образующих связь, называется длиной связи.
Из данных таблицы 1.4 видно, что в ряду этан — этилен — ацетилен с ростом кратности длина связи углерод-углерод уменьшается. То есть при образовании кратных связей атомы сильнее притягиваются друг к другу.
Таблица 4.1. Энергия и длина связи углерод-углерод в некоторых молекулах
|
Название вещества |
Структурная формула |
Энергия связи углерод-углерод, кДж/моль |
Длина связи углерод-углерод, нм |
|
Этан |
370 |
0,154 |
|
|
Этилен |
612 |
0,134 |
|
|
Ацетилен |
833 |
0,120 |
Как найти молекулярную форму и электронную геометрию молекулы OF2?
Чтобы найти геометрию (молекулярную/электронную) молекулы OF2, необходимо выполнить три шага. Они есть —
1) Найдите количество неподеленных пар, присутствующих на центральном атоме в структуре Льюиса молекулы OF2.
Количество неподеленных пар также можно найти по формуле
Одинокая пара = 1/2 * (VE – NA)
VE = валентный электрон на центральном атоме
NA = количество атомов, присоединенных к этому центральному атому
В молекуле OF2 валентных электронов центрального атома кислорода 6 и к нему присоединены два внешних атома.
Одинокие пары = 1/2 * (6 – 2) = 2
2) Найдите число гибридизации молекулы OF2
Гибридизацию центрального атома можно узнать по формуле.
Число гибридизации = NA + LP
Где NA = количество атомов, присоединенных к центральному атому
LP = количество неподеленных пар на центральном атоме
К центральному атому кислорода присоединены два атома, и на нем присутствуют две неподеленные пары.
Число гибридизации = 2+2 = 4
Число гибридизации молекулы OF2 равно 4.
Таким образом, гибридизация молекулы OF2 представляет собой Sp3.
3) Используйте теорию VSEPR для определения молекулярной/электронной геометрии OF2.
Мы определили гибридизация OF2 как SP3 и неподеленных пар 2
Теперь в соответствии с нотацией AXnEx теории VSEPR мы собираемся найти нотацию VSEPR для молекулы OF2.
нотация AXnEx
Где,
А: центральный атом
X: количество атомов, присоединенных к центральному атому
E: количество неподеленных пар электронов на центральном атоме.
Согласно Точечная структура Льюиса дифторида кислорода, кислород является центральным атомом, который имеет 2 неподеленные пары электронов и 2 атома фтора, связанные с ним.
Таким образом, формула OF2 становится AX2N2.
Согласно диаграмме VSEPR, молекула с формулой AX2N2 имеет молекулярную форму как изогнутый и электронная геометрия тетраэдрический.
| Всего доменов | Общая формула | Связанные атомы | Одинокие пары | Молекулярная форма | Электронная геометрия |
| 1 | AX | 1 | Линейные приводы | Линейные приводы | |
| 2 | AX2 | 2 | Линейные приводы | Линейные приводы | |
| AX | 1 | 1 | Линейные приводы | Линейные приводы | |
| 3 | AX3 | 3 | Тригональная планарная | Тригональная планарная | |
| AX2E | 2 | 1 | изогнутый | Тригональная планарная | |
| AXE2 | 1 | 2 | Линейные приводы | Тригональная планарная | |
| 4 | AX4 | 4 | четырехгранный | четырехгранный | |
| AX3E | 3 | 1 | Треугольная пирамида | четырехгранный | |
| AX2E2 | 2 | 2 | изогнутый | четырехгранный | |
| AXE3 | 1 | 3 | Линейные приводы | четырехгранный |
График ВСЕПР
Молекула — фтор
Таким образом, низкая энергия диссоциации молекул фтора и относительно большие значения энергии связи в соединениях фтора являются характерными чертами химии фтора. Фтор реагирует со всеми элементами, за исключением гелия, неона, аргона. Ни один из других элементов не реагирует с таким большим числом элементов. Кроме того, энергия активации для этих реакций большей частью довольно низка. Такое положение сохраняется также для большинства реакций фтора с бромидами и иодидами и в несколько меньшей степени с хлоридами. Поэтому фторирование элементарных веществ и галогенидов элементарным фтором является хорошим лабораторным методом получения неорганических фторидов. Фторирование неорганических окислов не всегда протекает до конца. Окислы с высокими энергиями решетки ( например, АЬОз) могут обладать очень высокими энергиями активации, и, следовательно, фторирование окислов фтором можно применять не всегда.
Объясните, почему при отрыве электрона от молекулы фтора наблюдается более значительное упрочнение связи, чем при отрыве электрона от молекулы кислорода, хотя из молекулы кислорода уходит один из двух разрыхляющих электронов, а из молекулы, фтора — только один из четырех.
Объясните, почему при отрыве электрона от молекулы фтора наблюдается более значительное упрочнение связи, чем при отрыве электрона от молекулы кислорода, хотя из молекулы кислорода уходит один из двух разрыхляющих электронов, а из молекулы фтора — только один из четырех.
Противоречие между сравнительно низким значением энергии диссоциации молекулы фтора ( Do ( F2) 37 ккал / моль) и высоким значением ее силовой постоянной ( ke 4 78 — W5 дин-см 1) объяснено Брауном на основании концепции валентных состояний.
Исключительная прочность молекул водорода ( например, прочнее молекул фтора в 2 7 раза) обусловливает высокие энергии активации химических реакций с участием молекулярного водорода. При обычных условиях в газообразном водороде активных молекул немного и молекулярный водород химически малоактивен. Он способен непосредственно соединяться лишь с наиболее активными из неметаллов — с фтором и на свету с хлором. Для инициирования реакций молекулярного водорода с другими веществами требуется нагрев или другие способы активации. При нагревании же молекулярный водород вступает в химическое взаимодействие со многими металлами, неметаллами и сложными веществами.
Фторирование посредством соединений, которые легко отдают атомы или молекулы фтора, например.
|
Относительная электроотрицательность элементов. |
Заметим, что энергия диссоциации на атомы меньше у молекул фтора, чем у хлора, хотя хлор в таблице Д. И. Менделеева расположен ниже фтора. Или, диссоциация 1 моля N2 сопровождается поглощением 170 2 ккал теплоты, а при диссоциации 1 моля Р2 поглощается 116 ккал.
|
Кривая атомного распределения жидкого брома при 23 С и 1 атм. |
Таким образом, есть основания думать, что между молекулами фтора действуют слабые химические силы того же порядка, что и между атомами аргона.
До сих пор известны лишь такие реакции, в которых молекула фтора выступает как окислитель, причем атом фтора присоединяет электрон.
Высокую химическую активность фтора следует объяснить тем, что на разрушение молекулы фтора требуется намного меньше энергии, чем ее выделяется при образовании новых связей.
Высокую химическую активность фтора следует объяснить тгм, что на разрушение молекулы фтора требуется намного меньше энергии, чем ее выделяется при образовании новых связей.
Если в молекуле кислорода химическая связь является двойной, то в молекуле фтора, несмотря на то, что электронов стало больше на 2, чем в молекуле кислорода, связь — ординарная.
Высокая активность свободного элемента частично обусловлена слабостью F-F — связи в молекуле фтора и высокой экзотермич-ностью реакций атомного фтора. Несмотря на то что в течение долгого времени трудно было точно измерить энергию диссоциации, величина 37 7 6 2 ккал / моль представляется в настоящее время хорошо установленной.