- Химические свойства карбоновых кислот
- Реакции образования солей
- Реакции с участием ОН группы
- Реакции замещения атомов водорода в углеводородном заместителе
- Особые химические свойства муравьиной кислоты
- Химические свойства сложных эфиров | Химия онлайн
- 1. Реакция гидролиза (омыления)
- Химические свойства. Сложные эфиры – типичные электрофилы
- Изомерия сложных эфиров
- Тест «Эфиры»
- Сложные эфиры в природе и технике
- Страницы
- 18.8.2. Гидролиз сложных эфиров
- 18.8.2.А. Механизмы гидролиза сложных эфиров
- Получение
- Закономерности протекания реакций
- Механизм реакций Вильямсона
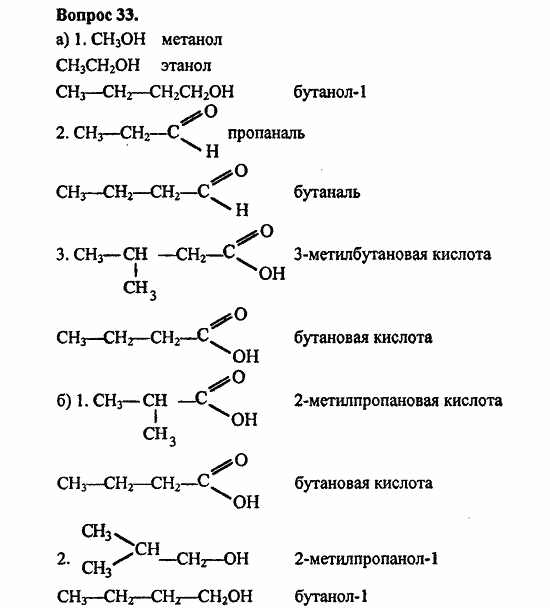
Химические свойства карбоновых кислот
Карбоновыми кислотами называют производные углеводородов, содержащие одну или несколько карбоксильных групп.
Карбоксильная группа:
Как можно видеть, карбоксильная группа состоит из карбонильной группы –С(О)- , соединенной с гидроксильной группой –ОН.
В связи с тем, что к гидроксильной группе непосредственно прикреплена карбонильная, обладающая отрицательным индуктивным эффектом связь О-Н является более полярной, чем в спиртах и фенолах. По этой причине карбоновые кислоты обладают заметно более выраженными, чем спирты и фенолы, кислотными свойствами. В водных растворах они проявляют свойства слабых кислот, т.е. обратимо диссоциируют на катионы водорода (Н+) и анионы кислотных остатков:
Реакции образования солей
С образованием солей карбоновые кислоты реагируют с:
1) металлами до водорода в ряду активности:
2) аммиаком
3) основными и амфотерными оксидами:
4) основными и амфотерными гидроксидами металлов:
5) солями более слабых кислот – карбонатами и гидрокарбонатами, сульфидами и гидросульфидами, солями высших (с большим числом атомов углерода в молекуле) кислот:
Систематические и тривиальные названия некоторых кислот и их солей представлены в следующей таблице:
| Формула кислоты | Название кислоты тривиальное/систематическое | Название соли тривиальное/систематическое |
| HCOOH | муравьиная/ метановая | формиат/ метаноат |
| CH3COOH | уксусная/ этановая | ацетат/ этаноат |
| CH3 CH2COOH | пропионовая/ пропановая | пропионат/ пропаноат |
| CH3 CH2 CH2COOH | масляная/ бутановая | бутират/ бутаноат |
Следует помнить и обратное: сильные минеральные кислоты вытесняют карбоновые кислоты из их солей как более слабые:
Реакции с участием ОН группы
Карбоновые кислоты вступают в реакцию этерификации с одноатомными и многоатомными спиртами в присутствии сильных неорганических кислот, при этом образуются сложные эфиры:
Данного типа реакции относятся к обратимым, в связи с чем с целью смещения равновесия в сторону образования сложного эфира их следует осуществлять, отгоняя более летучий сложный эфир при нагревании.
Обратный реакции этерификации процесс называют гидролизом сложного эфира:
Необратимо данная реакция протекает в присутствии щелочей, поскольку образующаяся кислота реагирует с гидроксидом металла с образованием соли:
Реакции замещения атомов водорода в углеводородном заместителе
При проведении реакций карбоновых с хлором или бромом в присутствии красного фосфора при нагревании происходит замещение атомов водорода при α-атоме углерода на атомы галогена:
В случае большей пропорции галоген/кислота может произойти и более глубокое хлорирование:
Особые химические свойства муравьиной кислоты
Молекула муравьиной кислоты, несмотря на свои малые размеры, содержит сразу две функциональные группы:
В связи с этим она проявляет не только свойства кислот, но также и свойства альдегидов:
При действии концентрированной серной кислоты муравьиная кислота разлагается на воду и угарный газ:
Химические свойства сложных эфиров | Химия онлайн
Большинство реакций сложных эфиров связано с нуклеофильной атакой по карбонильному атому углерода и замещением алкоксигруппы.
1. Реакция гидролиза (омыления)
Сложные эфиры легко гидролизуются (омыляются) на исходный спирт и кислоту водой (обратимо) или щелочами (необратимо, так как образующаяся карбоновая кислота превращается в соль). ![]()
![]()
Реакция этерификации в условиях кислотного катализа обратима. Обратный процесс – расщепление сложного эфира при действии воды с образованием карбоновой кислоты и спирта – называют гидролизом сложного эфира.![]()
Гидролиз в присутствии щелочи протекает необратимо (т.к. образующийся отрицательно заряженный карбоксилат-анион RCOO– не вступает в реакцию с нуклеофильным реагентом – спиртом).
![]()
Эта реакция называется омылением сложных эфиров (по аналогии со щелочным гидролизом сложноэфирных связей в жирах при получении мыла).
Восстановление сложных эфиров водородом приводит к образованию двух спиртов:![]()
![]()
Химические свойства. Сложные эфиры – типичные электрофилы
Сложные эфиры – типичные электрофилы. Из-за +М-эффекта атома кислорода, связанного с углеводородным радикалом, они проявляют менее выраженный электрофильный характер по сравнению с галогенангидридами и ангидридами кислот:
Электрофильность эфиров увеличивается, если углеводородный радикал образует с атомом кислорода сопряженную систему, т. н. активированные эфиры:
Сложные эфиры вступают в реакции нуклеофильного замещения.
1. Гидролиз сложных эфиров проходит как в кислой, так и в щелочной среде.
Кислотный гидролиз сложных эфиров – последовательность обратимых превращений, противоположных реакции этерификации:
Механизм этой реакции включает протонирование атома кислорода карбонильной группы с образованием карбкатиона, который реагирует с молекулой воды:
Щелочной гидролиз. Гидролиз в присутствии водных растворов щелочей проходит легче, чем кислотный потому, что гидроксид-анион более активный и менее объемный нуклеофил, чем вода. В отличие от кислотного, щелочной гидролиз необратим:
Щелочь выступает не в роли катализатора, а в роли реагента. Гидролиз начинается с нуклеофильной атаки гидроксид-ионом атома углерода карбонильной группы. Образуется промежуточный анион, который отщепляет алкоксид-ион и превращается в молекулу карбоновой кислоты. Алкоксид-ион, как более сильное основание, отрывает протон от молекулы кислоты и превращается в молекулу спирта:
Щелочной гидролиз необратим потому, что карбоксилат-анион имеет высокую делокализацию отрицательного заряда и не восприимчив к атаке спиртового гидроксила.
Часто щелочной гидролиз сложных эфиров называют омылением. Термин произошел от названия продуктов щелочного гидролиза жиров – мыла.
2. Взаимодействие с аммиаком (иммонолиз) и его производными протекает по механизму, аналогичному щелочному гидролизу:
3. Реакция переэтерификации (алкоголиз сложных эфиров) катализируется как минеральными кислотами, так и шеломами:
Для смешения равновесия вправо отгоняют более летучий спирт.
4. Сложноэфирная конденсация Кляйзена характерна для эфиров карбоновых кислот, содержащих атомы водорода в α-положении. Реакция протекает в присутствии сильных оснований:
Алкоксид-ион отщепляет протон от α-углеродного атома молекулы эфира. Образуется мезомерно стабилизированный карбанион (I), который, выступая в роли нуклеофила, атакует атом углерода карбонильной группы второй молекулы эфира. Образуется продукт присоединения (II). Он отщепляет алкоксид-ион и превращается в конечный продукт (III). Таким образом, всю схему механизма реакции можно разделить на три стадии:
Если в реакцию вступают два сложных эфира, содержащие α-атомы водорода, то образуется смесь четырех возможных продуктов. Реакция используется для промышленного получения ацетоуксусного эфира.
5. Восстановление сложных эфиров:
Первичные спирты образуются при действии газообразного водорода в присутствии скелетного никелевого катализатора (никель Ренея).
6. Действие магнийорганических соединений с последующим гидролизом приводит к образованию третичных спиртов:
Сложные эфиры имеют большое значение как ацилирующие реагенты, растворители, используются для синтеза альдегидов, кетонов, полимеров («органическоестекло» – плексиглас), лекарственных веществ: этилформиат – для производства витамина В1. Бензилбензоат используют для лечения чесотки. Эти вещества известны как отдушки в парфюмерии (этилформиат, этилацетат) и компоненты пищевых эссенций: грушевой – изоамил ацетат, яблочной – изоамилвалерат, ромовой – этилформиат, ананасовой – этилбутират,
Дата добавления: 2015-09-29; просмотров: 4212;
Изомерия сложных эфиров
- Изомерия углеродного скелета — самые различные вариации R и R1.
- Межклассовая изомерия — сложные эфиры изомерны карбоновым кислотам
Физические свойства ложных эфиров карбоновых кислот
Сложные эфиры низших карбоновых кислот и простейших одноатомных спиртов — летучие бесцветные жидкости с характерным, зачастую фруктовым запахом. Сложные эфиры высших карбоновых кислот — бесцветные твердые вещества.
![]()
Химические свойства
1. Гидролиз сложных эфиров карбоновых кислот — обратимая реакция:
![]()
взаимодействие ложные эфиров карбоновых кислот с щелочами дает соли:
![]()
Этот процесс называется «омыление эфиров»
Причем, если металл не одновалентный (Ca или Al, например), то соответственно изменяется и количество анионов:
2CH3COOC2H5 + Ca(OH)2 = (CH3COO)2Ca + 2C2H5OH
Получение сложных эфиров
Получение сложных эфиров — реакция этерификации:
R-COOH + R1OH -> RCOOR1 + H2O
В конце XIX — начале XX века, когда органический синтез делал свои первые шаги, было синтезировано и испытано фармакологами множество сложных эфиров карбоновых кислот. Они стали основой таких лекарственных средств, как салол, валидол и др. Как местнораздражающее и обезболивающее средство широко использовался метилсалицилат, в настоящее время практически вытесненный более эффективными средствами.
в ЕГЭ это вопрос А16 — Кислородсодержащие органические соединения
Тест «Эфиры»
Простые и сложные эфиры
1. Общая формула сложных эфиров: СnН2nO2 СnН2n+2O СnН2n+1O2 CnH2nO 2. Сложные эфиры образуются при взаимодействии: карбоновых кислот карбоновой кислоты и спирта спиртов простых эфиров и спиртов 3. сложные эфиры: подвергаются гидролизу в кислой среде подвергаются гидролизу в щелочной среде не подвергаются гидролизу гидролизуются в любой среде 4. Липиды — это: простые эфиры сложные эфиры многоатомные спирты высокомолекулярные кислоты 5. Выберите правильное утверждение: простые эфиры хорошо растворимы в воде простые эфиры практически не растворимы в воде растворимость в воде увеличивается с увеличением молярной массы эфиров растворимость в воде уменьшается с увеличением молярной массы эфиров 6. Простые эфиры: химически слабоактивные вещества химически активнее, чем спирты химически активнее, чем сложные эфиры химически активнее, чем кислоты 7. Простые эфиры изомерны: сложным эфирам кислотам спиртам альдегидам 8. При нагревании простого эфира с HI образуются: спирт и йодалкан алкан, йодалкан и вода алкен, вода и йодалкан два спирта и йодалкан 9. СH3OH + HNO3 -> C2H4 + H2O HCOH CH3-O-NO2 HCOOH 10. Определите формулу простого эфира, если плотность паров этого вещества по водороду равна 30. диэтиловый эфир диметиловый эфир метиловый эфир уксусной кислоты метил-этиловый эфир
Сложные эфиры в природе и технике
Сложные эфиры широко распространены в природе, находят применение в технике и различных отраслях промышленности. Они являются хорошими растворителями
органических веществ, их плотность меньше плотности воды, и они практически не растворяются в ней. Так, сложные эфиры с относительно небольшой молекулярной массой представляют собой легко воспламеняющиеся жидкости с невысокими температурами кипения, имеют запахи различных фруктов. Их применяют в качестве растворителей лаков и красок, ароматизаторов изделий пищевой промышленности. Например, метиловый эфир масляной кислоты имеет запах яблок, этиловый эфир этой кислоты — запах ананасов, изобутиловый эфир уксусной кислоты — запах бананов:
Страницы
- Главная страница
- ОСНОВЫ ОБЩЕЙ ХИМИИ
- 1.1 Важнейшие классы неорганических веществ
- 2.1 Вещества. Атомы
- 2.2 Размеры атомов
- 2.3 Молекулы. Химические формулы
- 2.4 Простые и сложные вещества
- 2.5 Валентность элементов
- 2.6 Моль. Молярная масса
- 2.7 Закон Авогадро
- 2.8 Закон сохранения массы веществ
- 2.9 Вывод химических формул
- 3.1 Строение атома. Химическая связь
- 3.2 Строение атома
- 3.4 Строение электронной оболочки атома
- 3.5 Периодическая система химических элементов
- 3.6 Зависимость свойств элементов
- 3.7 Химическая связь и строение вещества
- 3.8 Гибридизация орбиталей
- 3.9 Донорно-акцепторный механизм образования
- 3.10 Степени окисления элементов
- 4.1 Классификация химических реакций
- 4.2 Тепловые эффекты реакций
- 4.3 Скорость химических реакций
- 4.4 Необратимые и обратимые реакции
- 4.5 Общая классификация химических реакций
- НЕОРГАНИЧЕСКАЯ ХИМИЯ
- 5.1 Растворы. Электролитическая диссоциация
- 5.2 Количественная характеристика состава растворов
- 5.3 Электролитическая диссоциация
- 5.4 Диссоциация кислот, оснований и солей
- 5.5 Диссоциация воды
- 5.6 Реакции обмена в водных растворах электролитов
- 5.7 Гидролиз солей
- 6.1 Важнейшие классы неорганических веществ
- 6.2 Кислоты, их свойства и получение
- 6.3 Амфотерные гидроксиды
- 6.4 Соли, их свойства и получение
- 6.5 Генетическая связь между важнейшими классами
- 6.6 Понятие о двойных солях
- 7.1 Металлы и их соединения
- 7.2 Электролиз
- 7.3 Общая характеристика металлов
- 7.4 Металлы главных подгрупп I и II групп
- 7.5 Алюминий
- 7.6 Железо
- 7.7 Хром
- 7.8 Важнейшие соединения марганца и меди
- 8.1 Неметаллы и их неорганические соединения
- 8.2 Водород, его получение
- 8.3 Галогены. Хлор
- 8.4 Халькогены. Кислород
- 8.5 Сера и ее важнейшие соединения
- 8.6 Азот. Аммиак. Соли аммония
- 8.7 Оксиды азота. Азотная кислота
- 8.8 Фосфор и его соединения
- 8.9 Углерод и его важнейшие соединения
- 8.10 Кремний и его важнейшие соединения
- ОРГАНИЧЕСКАЯ ХИМИЯ
- 9.1 Основные положения органической химии. Углеводороды
- 9.2 Электронные эффекты заместителей в органических соединениях
- 9.3 Предельные углеводороды (алканы)
- 9.3.1 Насыщенные УВ. Метан
- 9.4 Понятие о циклоалканах
- 9.5 Непредельные углеводороды
- 9.6 Диеновые углеводороды (алкадиены)
- 9.7 Алкины
- 9.8 Ароматические углеводороды
- 9.9 Природные источники углеводородов
- 10.1 Кислородсодержащие органические соединения
- 10.2 Фенолы
- 10.3 Альдегиды
- 10.4 Карбоновые кислоты
- 10.5 Сложные эфиры. Жиры
- 10.6 Понятие о поверхностно-активных веществах
- 10.7 Углеводы
- 11.1 Амины. Аминокислоты
- 11.2 Белки
- 11.3 Понятие о гетероциклических соединениях
- 11.4 Нуклеиновые кислоты
- 12.1 Высокомолекулярные соединения
- 12.2 Синтетические волокна
18.8.2. Гидролиз сложных эфиров
Гидролиз сложных
эфиров катализируется как кислотами,
так и основаниями. Кислотный гидролиз
сложных эфиров проводят обычно при
нагревании с соляной или серной кислотой
в водной или водно-спиртовой среде.
В
органическом синтезе кислотный гидролиз
сложных эфиров чаще всего применяется
для моно- и диалкилзамещенных малоновых
эфиров (глава 17).
Моно- и дизамещенные
производные малонового эфира при
кипячении с концентрированной соляной
кислотой подвергается гидролизу с
последующим декарбоксилированием.
Последний способ
предпочтителен для омыления сложных
эфиров пространственно-затрудненных
кислот, другой модификацией этого метода
является щелочной гидролиз
пространственно-затрудненных сложных
эфиров в присутствии 18-краун-6-полиэфира:
Для препаративных
целей гидролиз, катализируемый основанием,
имеет ряд очевидных преимуществ по
сравнению с кислотным гидролизом.
Скорость основного гидролиза сложных
эфиров, как правило в тысячу раз выше,
чем при кислотном катализе. Гидролиз в
кислой среде является обратимым
процессом, в отличие от гидролиза в
присутствии основания, который необратим.
18.8.2.А. Механизмы гидролиза сложных эфиров
Гидролиз сложных
эфиров чистой водой в большинстве
случаев обратимая реакция, приводящая
к равновесной смеси карбоновой кислоты
и исходного сложного эфира:
Эта реакция в кислой
и щелочной средах сильно ускоряется,
что связано с кислотно-основным катализом
(гл. 3).
- Согласно К. Ингольду
механизмы гидролиза сложных эфиров
классифицируются по следующим критериям: - (1) Тип катализа:
кислотный (символ А) или основной (символ
В); - (2) Тип расщепления,
показывающий, какая из двух -связей
С-О в сложном эфире расщепляется в
результате реакции: ацил-кислород
(индекс АС) или алкил-кислород (индекс
АL):
(3) Молекулярность
реакции (1 или 2).
Из этих трех критериев
можно составить восемь различных
комбинаций, которые приведены на схеме
18.1.
Это наиболее часто
встречающиеся механизмы. Щелочное
омыление практически всегда относится
к типу ВАС2.
Кислотный гидролиз (а также этерификация)
в большинстве случаев имеет механизм
ААС2.
Механизм ААС1
обычно наблюдается только в сильно
кислых растворах (например, в конц.
H2SO4),
и особенно часто для эфиров пространственно
затрудненных ароматических кислот.
Механизм ВАС1
пока неизвестен.
Механизм ВАL2
найден только в случае исключительно
сильного пространственно экранированных
ацильных групп и нейтрального гидролиза
-лактонов.
Механизм АAL2
пока неизвестен.
По механизму АAL1
обычно реагируют третично-алкильные
сложные эфиры в нейтральной или кислой
среде. Эти же субстраты в подобных
условиях могут реагировать по механизму
ВАL1,
однако при переходе в чуть более щелочную
среду механизм ВАL1
сейчас же сменяется на механизм ВАС2.
Как видно из схемы
18.1, реакции, катализируемые кислотами,
обратимы, и из принципа микроскопической
обратимости (гл.2) следует, что и
катализируемая кислотами этерификация
тоже протекает по подобным механизмам.
Однако при катализе основаниями
равновесие сдвинуто в сторону гидролиза
(омыления), поскольку равновесие
сдвигается вследствие ионизации
карбоновой кислоты. Согласно приведенной
схеме в случае механизма ААС1
группы COOR и COOH протонируются по
алкоксильному или гидроксильному атому
кислорода.
Тем не менее в
небольших количествах в растворе
содержится и таутомерный катион —
необходимый интермедиат в механизме
ААС1.
Оба В1 — механизма (из которых ВАС1
неизвестен) на самом деле вовсе не
каталитические, ибо в начале происходит
диссоциация нейтрального эфира.
Из восьми ингольдовских
механизмов экспериментально доказаны
лишь шесть.
Получение
Сложные эфиры получают с помощью реакции этерификации из спиртов и карбоновых кислот:
CH3COOH + C2H5OH → CH3COOC2H5 + H2O.
Это наиболее важная реакция, которая обратима в ряде случаев: взаимодействуя с водой, образованный сложный эфир вновь распадается на начальные вещества.
Также сложные эфиры получают взаимодействием:
- ангидридов со спиртами:
(CH3CO)2O + 2C2H5OH → 2CH3COOC2H5 + H2O; - солей карбоновых кислот с галогенуглеводородами:
CH3(CH2)10COONa + CH3Cl → CH3(CH2)10COOCH3 + NaCl; - карбоновых кислот к алкенам:
CH3COOH + CH2=CH2 → CH3COOCH2CH3 + H2O.
При реакции этерификации от молекулы спирта отщепляется атом водорода, от кислоты – гидроксил.
Закономерности протекания реакций
Получение простого эфира по Вильямсону представляет собой обычную реакцию бимолекулярного нуклеофильного замещения у насыщенного атома углерода с помощью алкоксид- или феноксид-ионов.
По реакционной способности галоидные алкилы, которые можно использовать в реакциях Вильямсона можно расположить в ряд:
Рисунок 7.
Такое их расположение обусловлено изменением величин энергий связи $C-Hal$.
Изменение реакционой способности в ряде галоидных алкилов влияет на протекание реакций Вильямсона.
Например, для получения этилизопропилового эфира используют бромистый этил и натрийизопропилат
Рисунок 8.
но не бромистый изопропил и натрийэтилат.
Третичные галоидные алкилы, например трет-бутилхлорид, в условиях такого процесса полностью превращается в бутилен.
Если при отщеплении молекул $HHal$ можгут образовываться не один, а два изомерных продукта, то их выходы не будут одинаковы.
Например:
Рисунок 9.
В этих реакциях преимущественно образуется термодинамически более устойчивый продукт у которого в строении находится большее количество алкильных групп (правило Зайцева).
Термодинамическую устойчивость некоторых алкенов можно оценить по величинам теплот их гидрирования ($\triangle H$), значения которой приведены в таблице 1 для некоторых алкенов.
Таблица 1
Рисунок 10.
Сложные эфиры – функциональные производные карбоновых кислот, в молекулах которых гидроксильная группа (-ОН) замещена на остаток спирта (-OR)
Сложные эфиры карбоновых кислот – соединения с общей формулой
R–COOR’, где R и R’ – углеводородные радикалы.
Сложные эфиры предельных одноосновных карбоновых кислот имеют общую формулу CnH2nO2:
Физические свойства:
· Летучие, бесцветные жидкости
· Плохо растворимы в воде
· Чаще с приятным запахом
· Легче воды
Сложные эфиры содержатся в цветах, фруктах, ягодах. Они определяют их специфический запах. Являются составной частью эфирных масел (известно около 3000 эф.м. – апельсиновое, лавандовое, розовое и т. д.)
Эфиры низших карбоновых кислот и низших одноатомных спиртов имеют приятный запах цветов, ягод и фруктов. Эфиры высших одноосновных кислот и высших одноатомных спиртов – основа природных восков. Например, пчелиный воск содержит сложный эфир пальмитиновой кислоты и мирицилового спирта (мирицилпальмитат):
CH3(CH2)14–CO–O–(CH2)29CH3
|
Аромат. Структурная формула. |
Название сложного эфира |
|
Яблоко |
Этиловый эфир 2-метилбутановой кислоты |
|
Вишня |
Амиловый эфир муравьиной кислоты |
|
Груша |
Изоамиловый эфир уксусной кислоты |
|
Ананас |
Этиловый эфир масляной кислоты (этилбутират) |
|
Банан |
Изобутиловый эфир уксусной кислоты |
|
Жасмин |
Бензиловый эфир уксусной (бензилацетат) |
Краткие названия сложных эфиров строятся по названию радикала (R’) в остатке спирта и названию группы RCOO- в остатке кислоты. Например, этиловый эфир уксусной кислоты CH3COOC2H5 называется этилацетат.
Применение
· В качестве отдушек и усилителей запаха в пищевой и парфюмерной (изготовление мыла, духов, кремов) промышленности;
· В производстве пластмасс, резины в качестве пластификаторов.
Пластификаторы – вещества, которые вводят в состав полимерных материалов для придания (или повышения) эластичности и (или) пластичности при переработке и эксплуатации.
Применение в медицине
В конце XIX — начале ХХ века, когда органический синтез делал свои первые шаги, было синтезировано и испытано фармакологами множество сложных эфиров. Они стали основой таких лекарственных средств, как салол, валидол и др. Как местнораздражающее и обезболивающее средство широко использовался метилсалицилат, в настоящее время практически вытесненный более эффективными средствами.
Получение сложных эфиров
Cложные эфиры могут быть получены при взаимодействии карбоновых кислот со спиртами (реакция этерификации). Катализаторами являются минеральные кислоты.
Видео «Получение уксусноэтилового эфира»
Видео «Получение борноэтилового эфира»
Реакция этерификации в условиях кислотного катализа обратима. Обратный процесс – расщепление сложного эфира при действии воды с образованием карбоновой кислоты и спирта – называют гидролизом сложного эфира.
Механизм реакций Вильямсона
Реакция алкилирования алкоголятов галогеналкилами может происходить в основном по механизму как $SN1$, так и $SN2$ в зависимости от природы исходных соединений и условий процесса. Для алкоголятов первичных спиртов и первичных галогеналкил реализуется механизм $SN2$:
Рисунок 4.
В присутствии алкоксид-анионов, которые являются сильными основаниями, может происходить отщепление галогеноводородов с образованием алкена. Легче всего такое отщепление проходит для третичных галогеналкил, труднее для вторичных и тому подобное. Поэтому при синтезе смешанных эфиров целесообразнее использовать первичные галогеналкилы и алкоголяты третичных спиртов, позволит свести количество алкена к минимуму:
Рисунок 5.
Для этого процесса характерны те же самые ограничения, что и для других таких реакций. Если простой эфир содержит вторичные или третичные алкильные группы, их следует вводить с помощью алкоголятов, но не алкилгалогенидов или алкилсульфонатов, поскольку в этих случаях имеет место преимущественное или исключительное $E2$-элиминирование:
Рисунок 6.
Наилучшие результаты достигаются в том случае, когда в качестве алкилирующих агентов используются первичные алкилгалогениды и сульфонаты, а также аллил- и бензилгалогениды.