Содержание
В литий это металлический элемент, химический символ которого — Li, а его атомный номер — 3. Это третий элемент в периодической таблице и возглавляет группу 1 щелочных металлов. Из всех металлов у него самая низкая плотность и самая высокая удельная теплоемкость. Он настолько легкий, что может плавать по воде.
Его название происходит от греческого слова «lithos», что означает камень. Они дали ему такое название, потому что он был обнаружен именно в составе некоторых минералов в вулканических породах. Кроме того, он показал характерные свойства, аналогичные свойствам металлов натрия и кальция, обнаруженных в растительной золе.
![]()
Он имеет один валентный электрон, теряя его, чтобы стать катионом Li.+ в большинстве ваших реакций; или разделяя его ковалентной связью с углеродом, Li-C в литийорганических соединениях (таких как алкиллитий).
Его внешний вид, как и многие другие металлы, представляет собой твердое вещество серебристого цвета, которое может стать сероватым при воздействии влаги. Он может показывать черноватые слои (верхнее изображение), когда он реагирует с азотом в воздухе с образованием нитрида.
Химически он идентичен своим родственным соединениям (Na, K, Rb, Cs, Fr), но менее реактивен, поскольку его единственный электрон испытывает гораздо большую силу притяжения из-за того, что находится ближе к нему, а также из-за плохого экранирующего эффекта двух его электронов. внутренние электроны. В свою очередь, он реагирует как магний из-за эффекта смещения.
В лаборатории соли лития можно идентифицировать, нагревая их в зажигалке; появление интенсивного алого пламени подтвердит его присутствие. Фактически, он часто используется в учебных лабораториях для аналитических прогонов.
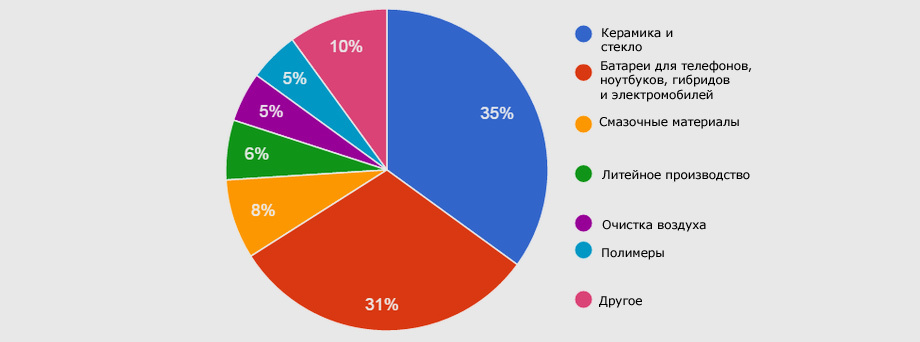
Его применение варьируется от использования в качестве добавки к керамике, стеклу, сплавам или литейным смесям до охлаждающей среды и создания высокоэффективных и небольших батарей; хотя и взрывоопасен, учитывая реактивную природу лития. Это металл с наибольшей тенденцией к окислению и, следовательно, тот, который легче всего отдает свой электрон.
Химические свойства
Литий является щелочным металлом, однако относительно устойчив на воздухе. Литий является наименее активным щелочным металлом, с сухим воздухом (и даже с сухим кислородом) при комнатной температуре практически не реагирует. По этой причине литий является единственным щелочным металлом, который не хранят в керосине (к тому же плотность лития столь мала, что он будет в нём плавать); он может непродолжительное время храниться на воздухе.
Во влажном воздухе медленно реагирует с азотом и другими газами, находящимися в воздухе, превращаясь в нитрид Li3N, гидроксид LiOH и карбонат Li2CO3.
6Li + N2 ⟶ 2Li3N
2Li + 2H2O ⟶ 2LiOH + H2
Поэтому длительно литий хранят в петролейном эфире, парафине, газолине и/или минеральном масле в герметически закрытых жестяных коробках.
В кислороде при нагревании горит, превращаясь в оксид Li2O.
4Li + O2 ⟶ 2Li2O
Интересная особенность лития в том, что в интервале температур от 100 °C до 300 °C он покрывается плотной оксидной плёнкой и в дальнейшем не окисляется. В отличие от остальных щелочных металлов, дающих стабильные надпероксиды и озониды; надпероксид и озонид лития — нестабильные соединения.
В 1818 немецкий химик Леопольд Гмелин установил, что литий и его соли окрашивают пламя в карминово-красный цвет, это является качественным признаком для определения лития. Температура самовоспламенения находится в районе 300 °C. Продукты горения раздражают слизистую оболочку носоглотки.
Спокойно, без взрыва и возгорания, реагирует с водой, образуя LiOH и H2.
-
- 2Li + 2H2O → 2LiOH + H2
Реагирует также с этиловым спиртом (с образованием этанолята):
2Li + 2C2H5OH ⟶ 2C2H5OLi + H2
Вступает в реакцию с водородом (при 500—700 °C) с образованием гидрида лития:
2Li + H2 ⟶ 2LiH
Реагирует с аммиаком при нагревании, при этом сначала образует амид лития (220 °C), а затем имид лития (400 °C):
2Li + 2NH3 ⟶ 2LiNH2 + H2
2Li + NH3 ⟶ Li2NH + H2
Реагируя с галогенами (с йодом — только при нагревании, выше 200 °C) образует соответствующие галогениды:
2Li + F2 ⟶ 2LiF
2Li + Cl2 ⟶ 2LiCl
2Li + Br2 ⟶ 2LiBr
2Li + I2 ⟶ 2LiI
При 130 °C реагирует с серой с образованием сульфида:
2Li + S ⟶ Li2S
В вакууме при температуре выше 200 °C реагирует с углеродом (образуется ацетиленид):
2Li + 2C ⟶ Li2C2
При 600—700 °C литий реагирует с кремнием с образованием силицида:
4Li + Si ⟶ Li4Si
Химически растворим в жидком аммиаке (−40 °C), образуется синий раствор.
В водном растворе ион лития имеет самый низкий стандартный электродный потенциал (−3,045 В) из-за малого размера и высокой степени гидратации иона лития.
Металлический литий вызывает ожоги при попадании на влажную кожу, слизистые оболочки и в глаза.
Бериллий (Be)
В клетке № 4 находится бериллий. Название произошло от минерала берилла — исходного сырья для получения металла бериллия. Сам же берилл получил название по индийскому городу Белур, в окрестностях которого он добывался с древних времён. Кому он был тогда нужен?
Вспомните волшебника Изумрудного города — Великого и Ужасного Гудвина. Он заставлял всех носить зелёные очки, чтобы его город казался «изумрудным», а значит, и очень богатым. Так вот, изумруд — одна из разновидностей берилла, некоторые изумруды ценятся дороже алмаза. Так что в древности знали, зачем разрабатывать месторождения берилла.
В пятитомной энциклопедии «Вселенная и человечество» 1896 года издания про бериллий написано: «Практического применения не имеет». И много ещё прошло времени, прежде чем люди разглядели его удивительные свойства. Например, бериллий внёс свой вклад в развитие ядерной физики. Именно после его облучения ядрами гелия учёные открыли такую важную элементарную частицу, как нейтрон.
Поистине уникальным является сплав бериллия с медью — бериллиевая бронза. Если большинство металлов со временем «стареет», теряет прочность, то бериллиевая бронза как раз наоборот, со временем «молодеет», её прочность возрастает. Пружины из неё практически не изнашиваются.
Литиекопатели
Удивительно, но при такой востребованности лития в
промышленности, унифицированного способа рентабельного промышленного освоения
литиевых месторождений нет. Они настолько немногочисленны и разнообразны, что
каждое требует собственного метода разработки.
Два основных технологических направления выделения лития из
содержащих его основ – рудное и гидроминеральное.
По первой схеме металл добывают из пегматитовых минералов,
которые состоят из кварца, полевого шпата, слюды и так далее. В Австралии,
например, его добывают из сподумена (руды лития, минерала, который относится к
пироксенам). Изначально это был основной источник лития в мире, но сейчас все
большее распространение получает другая технология.
![]()
Гидроминеральным способом литий добывают из глин солончаков.
Из них вымывают соль, содержащую гидроксид лития, затем этот рассол выпаривают
на солнце и осаждают, добавляя карбонат натрия и гидроксид кальция. Это
относительно дешевый способ, открывающий путь к неучтенным запасам лития
(солончаки не входят в списки разведанных месторождений), но очень долгий
(выпаривание занимает от 18 до 24 месяцев). Также полученный по такой
технологии литий имеет примеси: железо или магний. Тем не менее, именно этот
способ собирается использовать Илон Маск – компания Tesla, один из крупнейших
потребителей лития, получила право на самостоятельную добычу металла в штате
Невада, США. Это 10 тысяч акров богатых литием залежей глины.
Еще один источник лития – переработка литиевых батарей.
Однако это достаточно сложный и дорогой процесс. Сегодня металлический литий
получают вторичной переработкой в ничтожных объемах.
![]()
Происхождение лития
Через несколько минут после Большого взрыва Вселенная почти полностью состояла из водорода и гелия со следовыми количествами лития и бериллия и пренебрежимо малыми содержаниями всех более тяжелых элементов.
Синтез лития в условиях Большого взрыва
Нуклеосинтез Большого взрыва произвел и литий-7, и бериллий-7, и действительно последний доминирует в первичном синтезе нуклидов массы 7. С другой стороны, Большой взрыв произвел литий-6 на уровнях более чем в 1000 раз меньше. 74Быть позже распался через захват электронов (период полураспада 53,22 дня) в 73Ли, так что наблюдаемое первичное содержание лития по существу суммирует первичный 73Ли и радиогенный литий от распада 74Быть.
Эти изотопы образуются в результате реакций
-
31ЧАС + 42Он → 73Ли + γ 32Он + 42Он → 74Быть + γ
и уничтожен
-
74Быть + п → 73Ли + п 73Ли + п → 42Он + 42Он
Количество лития, образовавшегося в результате Большого взрыва, можно подсчитать.Водород-1 самый распространенный нуклид, составляющий примерно 92% атомов во Вселенной, с гелий-4 второй — 8%. Другие изотопы, включая 2ЧАС, 3ЧАС, 3Он, 6Ли, 7Ли и 7Быть гораздо реже; предполагаемое содержание первичного лития составляет 10−10 относительно водорода. Расчетная численность и соотношение 1Рука 4Он согласуется с данными наблюдений за молодыми звездами.
Филиал P-P II
В звездах литий-7 производится в протон-протонная цепная реакция.
Цепная реакция протон-протон II
-
32Он + 42Он → 74Быть + γ 74Быть + е− → 73Ли- + νе + 0,861 МэВ 0,383 МэВ 73Ли + 11ЧАС → 2 42Он
Ветвь P-P II доминирует при температурах от 14 до 23 МК.
Стабильные нуклиды первых элементов
Литий – новая нефть
Цены на карбонат лития стремительно растут: с $13 тыс. за
тонну в июле прошлого года до $75 тыс. в апреле 2022 года. Это вызывает ажиотаж
и дефицит – по данным Benchmark Mineral Intelligence запасы карбоната лития у
производителей аккумуляторов находятся на низком или нулевом уровне из-за
высокого спроса на производство аккумуляторов для электромобилей, при этом
текущие темпы добычи недостаточны. По оценке GlobalData к 2024 году спрос
увеличится в 2,5 раза, а прогноз МЭА говорит о том, что к 2040 году
востребованность лития на рынке вырастет аж в 40 раз.
Экстренная необходимость в развитии литиевой промышленности
вылилась в так называемую скоростную добычу. Крупнейшие добывающие компании
развернули масштабные «кампании» по поиску новых месторождений, а также по
разработке технологий извлечения лития.
По данным Геологической службы США (USGS) на 2021 год
выявленные ресурсы лития во всем мире значительно выросли и составляют около 86
млн тонн. Боливия обладает самыми большими запасами в мире — 21 млн тонн, за
ней следуют Аргентина (19,3 млн тонн), Чили (9,6 млн тонн), Австралия (6,4 млн
тонн), Китай (5,1 млн тонн), Демократическая Республика Конго (3 млн тонн),
Канада (2,9 млн тонн) и Германия (2,7 млн тонн). Однако всем очевидно, что
это лишь малая часть мировых запасов.
Основные поставки лития ведутся из Австралии (18,3 тыс. тонн
в год), затем идут Чили (14,1 тыс. тонн в год) и Аргентина (5,5 тыс. тонн в
год). Главенствующие позиции на мировой арене занимают компании Talison Lithium
Ltd (Австралия), SQM (Чили), Jiangxi Ganfeng Tianqi (Китай), FMC (Аргентина).
Месторождения лития были обнаружены в Австрии, Сербии и
Финляндии. В Европе также большие надежды на крупнейшие литиевые запасы Португалии.
Военные интриги Франции, России и Китая в Мали также связаны с контролем над
крупными месторождениями лития. Еще есть месторождения, расположенные в
Кировоградской, Донецкой, Днепропетровской и Житомирской областях, – многие
эксперты не исключают влияния этого факта на геополитический кризис на Украине.
![]()
Бор (В)
![]()
Бор занимает клетку № 5. Не надо думать, что этот элемент назвали в честь вратаря датского футбольного клуба «Академиск» Нильса Бора, впоследствии великого физика. Нет, своё имя элемент получил от персидского слова «бурах» или от арабского слова «бурак» (белый), которыми обозначали соединение бора — буру. Но мне больше нравится версия, что «бурак» не арабское, а чисто украинское слово, по-русски — «свёкла».
Бор — очень прочный материал, у него самый большой предел прочности на разрыв. Если соединение бора и азота нагреть до температуры 1350 °C при давлении 65 тысяч атмосфер (это сейчас технически достижимо), то можно получить кристаллы, способные поцарапать алмаз. Абразивные материалы, изготовленные на основе соединений бора, не уступают алмазным и при этом гораздо дешевле их.
В сплавы цветных и чёрных металлов бор обычно вводят для улучшения их свойств. Соединения бора с водородом — бораны — прекрасное ракетное топливо, почти в два раза эффективнее традиционного. Есть работа для бора и в сельском хозяйстве: бор добавляют в удобрения, потому что при его недостатке в почве заметно уменьшаются урожаи многих культур.
Художник Анна Горлач
Трехмерная структура соединения Na2He
Международная
группа ученых из МФТИ, Сколтеха, Нанкинского университета и Университета Стоуни Брук под руководством Артема Оганова предсказала
и смогла получить в лабораторных условиях стабильное соединение натрия с гелием
— Na 2 He. Подобные соединения могут возникать в недрах Земли и других планет, в условиях очень высокого давления и температуры. Исследование опубликовано в журнале Nature Chemistry
, кратко о статье сообщает также пресс-релиз Университета Юты. Следует отметить, что предварительная версия работы была выложена авторами в виде препринта в 2013 году.
Исследователи провели крупномасштабный поиск возможных стабильных соединений гелия с различными элементами (H, O, F, Na, K, Mg, Li, Rb, Cs и так далее) при помощи кода USPEX (Universal Structure Predictor: Evolutionary Xtallography), разработанного Огановым и его коллегами в 2004 году. Выяснилось, что только натрий образует устойчивое соединение с He при давлениях, доступных для лабораторных экспериментов. Тогда было решено поискать стабильное соединение системы Na-He с минимальной энтальпией образования (т.е. наиболее устойчивые) при разных давлениях. Расчеты показывают, что это будет соединение Na 2 He. Реакция образования этого вещества возможна при давлениях выше 160 ГПа, при этом она будет экзотермической, т.е. с выделением тепла. При давлениях ниже 50 ГПа соединение будет нестабильным.
![]()
Термодинамические характеристики системы Na-He при разных давлениях
Для проверки теоретических расчетов было решено попробовать получить предсказанное соединение при помощи алмазных наковален , нагреваемых лазерным излучением. В них загружались тонкие пластины из натрия, а все остальное пространство заполнялось газообразным гелием. Во время экспериментов ученые снимали Рамановские спектры , кроме того состояние системы контролировалось визуально и при помощи метода дифракции синхротронного рентгеновского излучения. Полученные данные затем сравнивались с предсказанными на основе расчетов.
![]()
Кристаллическая структура Na2He при 300 ГПа (a,b) и распределение электронной плотности в нем (c) нового родственника графена, две формы оксида алюминия, существующих при высоких давлениях, а также впервые «склеивание» слоев в сверхпроводнике, которое, как выяснилось, сопровождается потерей его сверхпроводящих свойств.
Александр Войтюк
Литий -Гелий. Мир ядра химического элемента.
Картинка 7 из презентации «Мир химии»
к урокам химии на тему «Химия»
Размеры: 960 х 720 пикселей, формат: jpg.
Чтобы бесплатно скачать картинку для урока химии,
щёлкните по изображению правой кнопкой мышки и нажмите «Сохранить изображение как…».
Для показа картинок на уроке Вы также можете бесплатно скачать презентацию «Мир химии.ppt»
целиком со всеми картинками в zip-архиве. Размер архива — 13988 КБ.
Число окисления
Сказав, что электронная конфигурация лития составляет 2 с1, вы можете потерять один электрон; два других, с внутренней орбиты 1с2, для их удаления потребуется много энергии.
Поэтому литий участвует почти во всех своих соединениях (неорганических или органических) со степенью окисления +1.Это означает, что в его связях Li-E, где E означает любой элемент, предполагается существование катиона Li.+ (будь то ионная или ковалентная фактически указанная связь).
Степень окисления -1 маловероятна для лития, поскольку он должен связываться с элементом, который гораздо менее электроотрицателен, чем он; Дело в том, что сам по себе этот металл очень электроположителен.
Эта отрицательная степень окисления будет представлять собой 2-х электронную конфигурацию.2 (чтобы получить электрон), и он также был бы изоэлектронен бериллию. Теперь предположим существование аниона Li.–, а его производные соли будут называться литуро.
Из-за большого окислительного потенциала его соединения в основном содержат катион Li.+, который из-за своего малого размера может оказывать поляризационное действие на объемные анионы с образованием ковалентных связей Li-E.
Планковская эпоха
Примерно 13,7 миллиарда лет назад наша Вселенная вдруг возникла. Внезапно. Из ничего. Считается, что изначально это была бесконечно горячая и бесконечно плотная точка.
Считается также, что четыре фундаментальные силы Вселенной (гравитация, электромагнитная сила, слабая ядерная сила и сильная ядерная сила) были объединены в это время в одну универсальную силу.
Эта «эпоха» длилась всего одну единицу времени Планка. Это наименьшая возможная единица времени. Она равна одной тысячной миллионной миллионной миллионной миллионной миллионной миллионной доле секунды. В конце этого отрезка времени Вселенная имела одну длину Планка в поперечнике. И содержала все ингредиенты, необходимые для создания Вселенной такой, какая она есть сегодня.
Тайны благородных газов
Первичная материя Вселенной, возникшая через несколько сотен миллионов лет после Большого Взрыва, состояла всего из трех элементов — водорода, гелия и следовых количеств лития. Гелий и сегодня является третьим по распространенности элементом мироздания, однако на Земле его встречается крайне мало, и запасы гелия на планете постоянно уменьшаются из-за того, что он улетучивается в космос.
Отличительной чертой гелия и других элементов восьмой группы таблицы Менделеева, которых ученые называют «благородными газами», является то, что они крайне неохотно — в случае ксенона и других тяжелых элементов — или в принципе, как неон, не способны вступать в химические реакции. Существует лишь несколько десятков соединений ксенона и криптона с фтором, кислородом и другими сильными окислителями, ноль соединений неона и одно соединение гелия, обнаруженное экспериментальным путем в 1925 году.
Это соединение, объединение протона и гелия, не является настоящим химическим соединением в строгом смысле этого слова — гелий в данном случае не участвует в образовании химических связей, хотя и влияет на поведение атомов водорода, лишенных электрона. Как раньше предполагали химики, «молекулы» этого вещества должны были встречаться в межзвездной среде, однако за последние 90 лет астрономы так и не обнаружили их. Возможной причиной этого является то, что данный ион крайне нестабилен и разрушается при контакте с почти любой другой молекулой.
Артем Оганов и его команда задумались, могут ли соединения гелия существовать при экзотических условиях, о которых земные химики задумываются крайне редко — при сверхвысоких давлениях и температурах. Оганов и его коллеги достаточно давно изучают подобную «экзотическую» химию и даже разработали специальный алгоритм для поиска веществ, существующих в таких условиях. При его помощи они обнаружили, что в недрах газовых гигантов и некоторых других планет может существовать экзотическая ортоугольная кислота, «невозможные» версии обычной поваренной соли, и ряд других соединений, «нарушающих» законы классической химии.
Используя эту же систему, USPEX, российские и зарубежные ученые обнаружили, что при сверхвысоких давлениях, превышающих атмосферное в 150 тысяч и миллион раз, существует сразу два стабильных соединения гелия — оксигелид натрия и гелид натрия. Первое соединение состоит из двух атомов натрия и одного атома гелия, а второе — из кислорода, гелия и двух атомов натрия.
Литий (Li)
Клетку № 3 занимает литий. Литий своё название получил от греческого слова λίθος (камень), так как первоначально был обнаружен в минералах.
Бывает так называемое железное дерево, тонущее в воде, а бывает особо легкий металл литий — он, наоборот, в воде не тонет. И не только в воде — ни в какой другой жидкости тоже. Плотность лития почти в 2 раза меньше плотности воды. Он вообще не очень похож на металл — слишком мягкий. Да и плавать долго не мог бы — в воде литий с шипением растворяется.
Небольшие добавки лития повышают прочность и пластичность алюминия, что очень важно в авиации и ракетостроении. При реакции пероксида лития с углекислым газом выделяется кислород, что применяется для очистки воздуха в изолированных помещениях, например, на подводных лодках или космических кораблях
Структура
Согласно модели большого взрыва, все шесть изотопов трех самых легких элементов были созданы в ранней Вселенной. Обычно прогнозы модели о том, сколько каждого изотопа было образовано, выражаются в соотношении пяти этих изотопов (дейтерий, гелий-3, гелий-4, литий-6 и литий-7) к нормальному водороду.
Скептик Лоуренс Краусс настолько уверен в этих утверждениях, что говорит, будто он специально носит карту в своем кошельке, чтобы показывать людям, которые не верят в большой взрыв.1 Эта карта показывает соотношение прогнозируемого множества четырех изотопов, а также области, отображающие измеренные диапазоны четырех изотопов (см. изображение ниже).
Краусс говорит, что он обычно не заходит глубоко в дискуссию с теми, кто сомневается в большом взрыве, потому что данные редко впечатляют людей, которые решили заранее, что с изображением что-то не так. Большинство людей, смотря на схему, все равно не поймут ее, так что это прекрасная возможность для Краусса обмануть и запугать большинство соперников.
Насколько хорошо обосновано сопоставление данных и прогнозов, которые предсказывает Краусс? Не так хорошо, как он думает.
Изучая изображение, теоретические и наблюдаемые уровни гелия-4 и дейтерия, по-видимому, хорошо согласуются. Краусс признает, что данных для гелия-3 мало, и только верхние пределы его количества сопоставимы с теорией, исходя из этого действительно нельзя сделать вывод.
Наконец, участок лития-7 также, как утверждается, хорошо согласуется с теорией большого взрыва и астрономическими измерениями. Однако это неверно, поскольку теоретические и наблюдаемые количества лития не совпадают вообще — измеренное количество лития во Вселенной по крайней мере в три раза ниже, чем прогнозируемое.
Краусс либо использовал старые данные, либо неправильно нанес их. Проблема лития известна на протяжении некоторого времени. Например, за год до появления книги Краусса Филдс опубликовал статью на эту тему. Следовательно, утверждение Краусса о том, что теория и данные идеально сочетаются, неверны.
В последнее время проблема лития только ухудшилась. Изображение Краусса показывает не литий-7, а скорее показывает как литий-7, так и литий-6. Теория крупномасштабного нуклеосинтеза предсказывает, что количество лития-6 должна составлять около 0,0015% от лития-7, поэтому сторонники большого взрыва полагают, что любой вклад лития-6 будет несущественным по сравнению с литием-7.
Кроме того, учитывая это несоответствие и тот факт, что спектральные линии лития-6 со звезд совпадают со спектрами лития-7, измерения содержания лития-6 затруднены. Однако трудно не значит невозможно.
В последние годы очень тщательные исследования количества лития-6 в некоторых звездах показали, что литий-6 составляет примерно 5% количества лития-7. Это число примерно в 1000 раз больше, чем прогнозы нуклеосинтеза большого взрыва. Следовательно, хотя количество лития-7 ниже, чем прогнозировалось, литий-6 оказался гораздо более распространенным, чем предсказывалось.
Было предложено несколько причин несоответствия теории и наблюдений, но каждая из них была устранена. Например, одно из предложений заключалось в том, что мы не знали поперечного профиля ядерной реакции, которая образовала литий-6 в ранней Вселенной большого взрыва, но недавнее исследование исключило эту возможность.
Интересно, что литиевая проблема касается и Солнца. В Солнце очень мало лития по сравнению с другими похожими звездами. На самом деле, количество лития в Солнце одно из самых низких среди всех звезд. Неясно, что это значит и как это связано с литиевой проблемой большого взрыва.
Как обстоят дела с литием в России
В России запасы лития есть, но его никто не добывает. Во-первых, стартовый акционный платеж, с которого начинаются торги (по закону российские литиевые месторождения государство распределяет только через аукцион), стоит слишком дорого. Так, стартовый платеж на месторождении Кольского полуострова достигает 1 млрд 100 млн рублей. А затраты на разведку, по оценкам геологов, могут составить еще 500-600 млн рублей.
Подтвержденные запасы редкого металла есть на Кольском полуострове, в республике Тува, в Иркутской области — все это рудные месторождения. Первый и единственный литиевый рудник, на котором велась добыча, расположен в Забайкалье. В советские годы там отработали около 40% запасов, а в 1997 году месторождение законсервировали «из-за неблагоприятной экономической обстановки». Сейчас стартовый аукционный платеж там стоит 3 млрд рублей.
Кроме того, в октябре 2020 года правительство подняло налог на добычу полезных ископаемых в два раза, что создало преграду для разработки новых месторождений.
«Почти все российские запасы лития были подсчитаны и поставлены на баланс в конце 50-х годов XX века. До последнего времени они не были никому интересны, потому что необходимость в литии была небольшая. Один рудник в Забайкалье перекрывал все потребности», — вспоминает Ворогушин.
Электробусы с новогодним оформлением на площади Киевского вокзала в Москве. Фото: Владимир Астапкович / РИА Новости
Все российские заводы, которые производят литиевые аккумуляторы, закупают иностранное сырье. Например, летом 2019 года Росатом и министерство энергетики Боливии договорились о совместной разработке боливийских месторождений лития. Для аккумуляторов используют только высокочистый литий — такой производят на трех заводах в России, отмечает геолог. Один из производителей литий-ионных аккумуляторов и систем на их основе — компания «Лиотех» в Новосибирске, портфельная компания РОСНАНО. «Лиотех» подтвердил нам, что сырье для аккумуляторов действительно поступает из-за границы: предприятие использует катодные порошки китайского производства.
«Закупка иностранного сырья сопряжена с типовыми сложностями закупки иностранных товаров: поиск надежного поставщика, качественного сырья, сроки доставки, стоимость доставки и тд. По сравнению со стоимостью сырья для китайских производителей аккумуляторов конечно удорожает, поскольку возникают дополнительные расходы на логистику», — объяснили «Экосфере» в пиар-службе компании.
По словам Ворогушина, на данный момент Россия зависит от иностранных поставщиков лития и скачков цен на рынке, хотя было бы разумно создать собственное производство полного цикла.